Dostęp do tego artykułu jest płatny.
Zapraszamy do zakupu!
Cena: 12.50 PLN (z VAT)
Kup artykuł
Po dokonaniu zakupu artykuł w postaci pliku PDF prześlemy bezpośrednio pod twój adres e-mail.
MS 2021; 7-8: 32-37.
Mucous membrane pemphigoid – diagnostic and treatment dilemmas. A case report
Angelika Wójcicka‑Rubin, Marcin Gołębiowski, Agnieszka Żebrowska
Streszczenie
Wprowadzenie. Pemfigoid błon śluzowych (MMP) należy do heterogennej grupy przewlekłych podnabłonkowych chorób pęcherzowych, które manifestują się objawami ze strony błon śluzowych, sporadycznie skóry. Występuje przede wszystkim u kobiet w wieku 60‑80 lat. W zakresie jamy ustnej zmiany chorobowe obejmują głównie podniebienie i dziąsła. Jednym z najczęstszych objawów MMP jest zapalenie złuszczające dziąseł. Rozpoznanie MMP często bywa opóźnione ze względu na niecharakterystyczne zmiany na początku choroby oraz ze względu na niejednoznaczny wynik histopatologiczny. Odpowiedź na leczenie jest zróżnicowana, a rokowanie nieprzewidywalne.
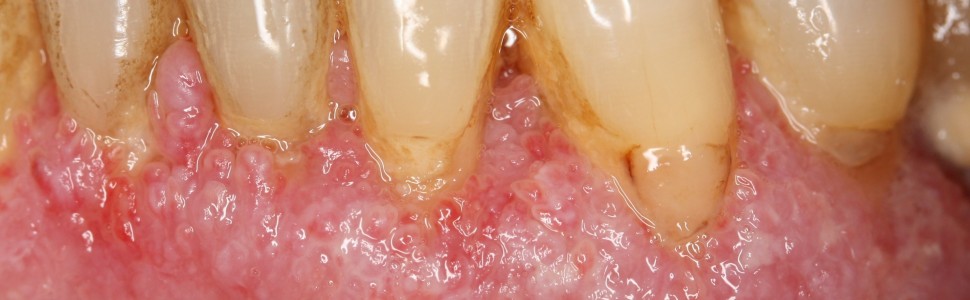
Opis przypadku. Pacjentka, lat 60, ogólnie zdrowa, zgłosiła się z powodu bolesnych owrzodzeń i objawu złuszczania dziąseł, obserwowanych od roku. W badaniu wewnątrzustnym stwierdzono niejednolity rumień dziąseł z ziarniniakowatymi zmianami wzdłuż brzegu dziąsła, z pojedynczym wrzodziejącym kraterem w okolicy zęba 26. Brak było chorobowych zmian ocznych lub skórnych. Pobrane wycinki ze zmienionej błony śluzowej oraz jej okolicy nie wykazały swoistości dla żadnej choroby autoimmunologicznej. Miejscowo zastosowane kortykosteroidy i takrolimus były nieskuteczne, a zmiany chorobowe dziąseł ulegały uogólnieniu. Po upływie 5 miesięcy wykonano kolejną biopsję. Bezpośredni test immunofluorescencji (DIF) wykazał obecność linijnych złogów dopełniacza (C3) i IgG wzdłuż błony podstawnej. W badaniu histopatologicznym stwierdzono akantotyczny rozrost nabłonka płaskiego z cechami zapalenia, co nie odpowiada typowemu obrazowi MMP. Jednakże według konsensusu Europejskiej Akademii Dermatologii i Wenerologii oraz Polskiego Towarzystwa Dermatologicznego, to badanie DIF jest rozstrzygające w rozpoznaniu MMP. We współpracy z dermatologiem zastosowano terapię ogólną. Niestety wdrożone kortykosteroidy były nieskuteczne i powodowały poważne skutki uboczne (nagłe pogorszenie wzroku). Terapię zmieniono na leczenie metotreksatem i azatiopryną z lepszymi wynikami klinicznymi.
Opis przypadku. Pacjentka, lat 60, ogólnie zdrowa, zgłosiła się z powodu bolesnych owrzodzeń i objawu złuszczania dziąseł, obserwowanych od roku. W badaniu wewnątrzustnym stwierdzono niejednolity rumień dziąseł z ziarniniakowatymi zmianami wzdłuż brzegu dziąsła, z pojedynczym wrzodziejącym kraterem w okolicy zęba 26. Brak było chorobowych zmian ocznych lub skórnych. Pobrane wycinki ze zmienionej błony śluzowej oraz jej okolicy nie wykazały swoistości dla żadnej choroby autoimmunologicznej. Miejscowo zastosowane kortykosteroidy i takrolimus były nieskuteczne, a zmiany chorobowe dziąseł ulegały uogólnieniu. Po upływie 5 miesięcy wykonano kolejną biopsję. Bezpośredni test immunofluorescencji (DIF) wykazał obecność linijnych złogów dopełniacza (C3) i IgG wzdłuż błony podstawnej. W badaniu histopatologicznym stwierdzono akantotyczny rozrost nabłonka płaskiego z cechami zapalenia, co nie odpowiada typowemu obrazowi MMP. Jednakże według konsensusu Europejskiej Akademii Dermatologii i Wenerologii oraz Polskiego Towarzystwa Dermatologicznego, to badanie DIF jest rozstrzygające w rozpoznaniu MMP. We współpracy z dermatologiem zastosowano terapię ogólną. Niestety wdrożone kortykosteroidy były nieskuteczne i powodowały poważne skutki uboczne (nagłe pogorszenie wzroku). Terapię zmieniono na leczenie metotreksatem i azatiopryną z lepszymi wynikami klinicznymi.
Wnioski. Kryteria diagnostyczne MMP muszą być oparte na obrazie klinicznym, jak również na obecności pewnych cech immunopatologicznych. Ponieważ choroba występuje stosunkowo rzadko, a pierwsze objawy mogą być niespecyficzne, MMP może zostać błędnie rozpoznany we wczesnym stadium. Do rozpoznania i właściwego leczenia MMP niezbędna jest współpraca z dermatologiem.
Abstract
Background. Mucous membrane pemphigoid (MMP) is a heterogeneous group of chronic, autoimmune subepithelial blistering diseases which predominantly involves the mucous membranes and occasionally the skin. MMP predominantly affects women, usually between 60 and 80 years of age. Oral lesions predominantly affect palate and gingiva. Desquamative gingivitis is one of the main clinical sign of MMP. Diagnosis of MMP is often delayed because of the non‑specific presentations in the early stage or inconclusive histopathology. The response to treatment is different among MMP patients and the prognosis is unpredictable.
Case report. A 60‑year‑old female patient presented with a one‑year history of painful ulcers and peeling of the gingiva. General history was non‑contributory. Intraoral examination revealed patchy gingival erythema with granulomatous masses along the gingival margin with a single ulcerative crater in the region of tooth 26 with no evidence of ocular or cutaneous lesions. Initial biopsies of lesional and perilesional mucosa revealed no specificity for any autoimmune disease. Topical corticosteroids and tacrolimus were ineffective, and gingival lesions became generalized. Five months later, another biopsy was taken. Direct immunofluorescence test showed continuous, linear deposits of complement and IgG along the basement membrane zone. Histopathology demonstrated the subepithelial split with an inflammatory infiltrate of lymphocytes. Together, clinical and immunopathologic features favored a final diagnosis of MMP. In cooperation with a dermatologist, a systemic therapy was administered. Unfortunately, corticosteroids were ineffective and produced severe adverse effects (sudden deterioration of vision). Methotrexate and azathioprine therapy was then administered with a better clinical outcome.
Case report. A 60‑year‑old female patient presented with a one‑year history of painful ulcers and peeling of the gingiva. General history was non‑contributory. Intraoral examination revealed patchy gingival erythema with granulomatous masses along the gingival margin with a single ulcerative crater in the region of tooth 26 with no evidence of ocular or cutaneous lesions. Initial biopsies of lesional and perilesional mucosa revealed no specificity for any autoimmune disease. Topical corticosteroids and tacrolimus were ineffective, and gingival lesions became generalized. Five months later, another biopsy was taken. Direct immunofluorescence test showed continuous, linear deposits of complement and IgG along the basement membrane zone. Histopathology demonstrated the subepithelial split with an inflammatory infiltrate of lymphocytes. Together, clinical and immunopathologic features favored a final diagnosis of MMP. In cooperation with a dermatologist, a systemic therapy was administered. Unfortunately, corticosteroids were ineffective and produced severe adverse effects (sudden deterioration of vision). Methotrexate and azathioprine therapy was then administered with a better clinical outcome.
Conclusions. MMP’s diagnostic criteria must be based on the clinical presentation as well as on the presence of certain immunopathologic features. However, as the disease is relatively uncommon and first symptoms might be non‑specific, MMP may be misdiagnosed at the early stage. Collaboration with a dermatologist is necessary for the diagnosis and proper treatment of MMP.
Hasła indeksowe: pemfigoid błon śluzowych, pemfigoid/leczenie, immunofluorescencja bezpośrednia, błona śluzowa jamy ustnej
Key words: mucous membrane pemphigoid, pemphigoid/drug therapy, direct immunofluorescence, oral mucosa
PIŚMIENNICTWO
-
Woźniak K, Dmochowski M, Placek W i wsp. Pemphigoid – diagnostyka i leczenie. Konsensus Polskiego Towarzystwa Dermatologicznego. Przegl Dermatol. 2016; 103(1): 19-34.
-
Saschenbrecker S, Karl I, Komorowski L i wsp. Serological diagnosis of autoimmune bullous skin diseases. Front Immunol. 2019; 10: 1974.
-
Cizenski JD, Michel P, Watson IT i wsp. Spectrum of orocutaneous disease associations. Immune-mediated conditions. J Am Acad Dermatol. 2017; 77(5): 795-806.
-
Suresh L, Neiders ME. Definitive and differential diagnosis of desquamative gingivitis through direct immunofluorescence studies. J Periodontol. 2012; 83(10): 1270-1278.
-
Beutner EH, Jordon RE, Chorzelski TP. The immunopathology of pemphigus and bullous pemphigoid. J Invest Dermatol. 1968; 51(2): 63-80.
-
Amber KT, Murrell DF, Schmidt E i wsp. Autoimmune subepidermal bullous diseases of the skin and mucosae. Clinical features, diagnosis, and management. Clin Rev Allergy Immunol. 2018; 54(1): 26-51.
-
Shimanovich I, Nitz JM, Zillikens D. Multiple and repeated sampling increases the sensitivity of direct immunofluorescence testing for the diagnosis of mucous membrane pemphigoid. J Am Acad Dermatol. 2017; 77(4): 700-705.
-
Machado-Pinto J, McCalmont TH, Golitz LE. Eosinophilic and neutrophilic spongiosis. Clues to the diagnosis of immunobullous diseases and other inflammatory disorders. Semin Cutan Med Surg. 1996; 15(4): 308-316.
-
Setterfield J, Shirlaw PJ, Kerr-Muir M i wsp. Mucous membrane pemphigoid. A dual circulating antibody response with IgG and IgA signifies a more severe and persistent disease. Br J Dermatol. 1998; 138(4): 602-610.
-
Cozzani E, Drosera M, Parodi A i wsp. Frequency of IgA antibodies in pemphigus, bullous pemphigoid and mucous membrane pemphigoid. Acta Derm Venereol. 2004; 84(5): 381-384.
-
Santi CG, Gripp AC, Roselino AM i wsp. Consensus on the treatment of autoimmune bullous dermatoses. Bullous pemphigoid, mucous membrane pemphigoid and epidermolysis bullosa acquisita – Brazilian Society of Dermatology. An Bras Dermatol. 2019; 94(2 Suppl 1): 33-47.
-
Porat Ben Amy D, Kassem R. Custom-made trays for targeted treatment of oral vesiculobullous diseases. A proposed protocol. Dermatol Ther. 2020: 33(6): e14446.
-
Łuksza L, Glasner L, Iwaszkiewicz-Bilikiewicz B i wsp. Polekowe uszkodzenia narządu wzroku. Forum Med Rodz. 2007; 1(3): 264-271.